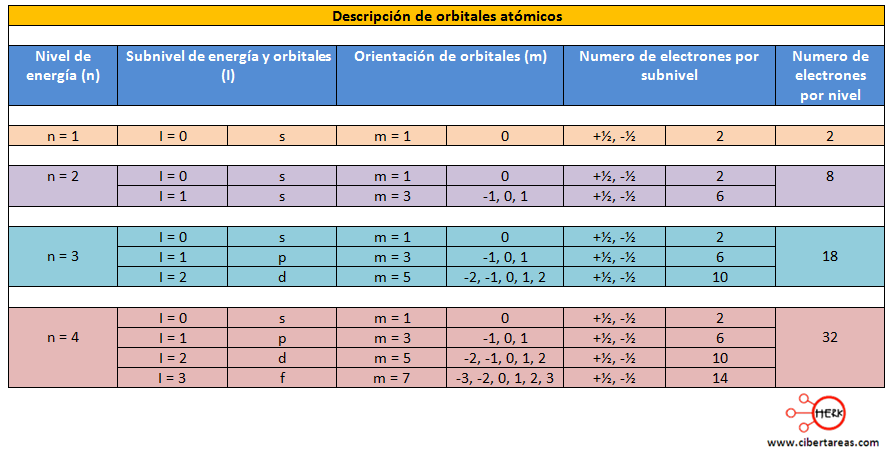
En algunos tomos, los orbitales de los subniveles atmicos s y p mezclarse, dando origen a orbitales hbridos sp, sp y sp. Segn la teora de los enlaces covalentes, un enlace de este tipo se efecta por la superposicin de orbitales semi llenados (apenas con un electrn). La hibridacin explica la formacin de algunos enlaces. Los orbitales que se combinan siempre deben de estar en la misma rbita o nivel de energa; as, si se combina un orbital s de la rbita dos, con un orbital p de la misma rbita, se obtienen dos orbitales hbridos denominados orbitales sp, y entonces se dice que el tomo tiene una hibridacin sp; por otro lado, si se combina un orbital. Anteriormente vimos las figuras de las representaciones grficas de los orbitales atmicos. En aquellas de los orbitales p, d y f, suelen aparecer signos ( y ) o dos tipos de colores o rayados en los lbulos. Ello es debido a que la funcin de. Cuando n3, l puede equivaler a 2, y cuando l2, m puede equivaler a 2, 1, 0, 1 y 2. Los orbitales l2 se llaman orbitales d, y hay cinco tipos distintos correspondiendo a los diferentes valores de. Niveles de energa, subniveles y orbitales del tomo Cada electrn ocupa un orbital atmico definido por el conjunto de nmeros cunticos, los cuales a su vez determinan el nivel de energa. A su vez, cada nivel tiene sus electrones repartidos en distintos subniveles, que pueden ser de cuatro tipos: s, p, d, f. En cada subnivel hay un nmero determinado de orbitales que pueden contener, como mximo, 2 electrones cada uno. Las imgenes proporcionan nuevas pruebs en el debate sobre los tipos de enlaces que se dan en una molcula hecha de tomos de oxgeno y cobre. Descubre el concepto de orbital atmico. Explora los distintos orbitales atmicos s, p, d, f y su relacin con los nmeros cunticos l y ml. 2 Formacin de orbitales moleculares a partir de orbitales atmicos La TOM describe la situacin electrnica de las molculas en trminos de orbitales moleculares cuyo papel en las mismas es similar al que cumplen los orbitales atmicos en los tomos. tipos de orbitales atmicos existen cuatro tipos de orbitales atmicos, que se identifican con el nmero cuntico l. valor de l tipo de orbital los pares electronicos pueden ser compartidos cuando un orbital parcialmente lleno de un tomo se sobrepone con otro orbital parcialmente lleno de. El nmero de orbitales en una subcapa es igual al nmero de valores permitidos de m l para un valor particular de l, por lo que el nmero de orbitales en una subcapa es 2l1. Los nombres de los orbitales son los mismos que los de las subcapas en las que aparecen. La Hibridacin tiene diversos significados, pero el significado que se le da en el mundo de la qumica es del proceso en el cual se forman orbitales electrnicos hbridos para formar as orbitales apropiados para crear distintos tipos de enlaces. El principio de aufbau: Los orbitales se llenan de manera que primero se completan los de menor energa (Aufbau: es la palabra alemana que significa construccin). La regla de Hund: Cuando se trata con orbitales de igual energa (orbitales degenerados) como los tres orbitales p. Si te piden de un electrn cualquiera de la ltima capa, entonces pon lo de m 1, 0, 1 (en el caso de que la ltima capa sean orbitales p), ya que te estaran pidiendo tanto los que estn en un orbital px, como py y pz, y esto hace que cambie su nmero cuntico m. 927 pudo comprobarse experimentalmente la hiptesis de De Broglie al observarse un comportamiento ondulatorio de los electrones en los fenmenos de difraccin. Un electrn que se mueve alrededor de ncleo puede considerarse ligado a l y podemos describir su movimiento ondulatorio mediante la ecuacin de ondas. La imagen de los orbitales empleada habitualmente por los qumicos consiste en una representacin del orbital mediante superficies lmite que engloban una zona del espacio donde la probabilidad de encontrar al electrn es del 99. Orbitales p La forma geomtrica de los orbitales p es la de dos esferas achatadas hacia el punto de contacto (el ncleo atmico) y orientadas segn los ejes de coordenadas. Tambin para efectos de comprensin, la comunidad cientfica ha aceptado que los nmeros que representan los subniveles (0, 1, 2, y 3) sean reemplazados por las letras s, p, d y f, respectivamente, para representar los distintos tipos de orbitales. Los orbitales de electrones son el volumen de espacio en donde un electrn tiene el 95 de posibilidades de encontrarse. Existen diferentes tipos de orbitales, con diferentes formas. En cada orbital pueden ubicarse un mximo de dos electrones. La teora de la hibridacin propuso que en el caso del tomo de carbono, Para que fuera tetravalente y sus orbitales equivalentes, sera necesario combinar (hibridar) los orbitales atmicos 2s y los tres 2p, y de esa combinacin obtener cuatro orbitales hbridos. Considera que los orbitales atmicos se pueden combinar entre ellos (las funciones matemticas de los orbitales atmicos, ya que es nicamente un desarrollo matemtico) para dar lugar a unos orbitales resultado de dicha combinacin (mezclas) que llamamos orbitales hbridos. En el segundo nivel de energia tenemos dos tipos de orbitales, los s y los p. dos tipos de orbitales, pero hay un orbital s y hay tres orbitales p (px, py, pz), por lo tanto en el segundo nivel hay cuatro orbitales atomicos. Los niveles de Energa son estados energticos en donde se pueden encontrar los electrones en estados estables o no, segn el subnivel en que se encuentran ya sea. Hay tres orbitales p por nivel de energa, cada uno con forma de hlice. Cada uno de los orbitales p sostiene dos electrones, para un total de seis electrones en los orbitales p. De acuerdo con la Regla de Hund, cada orbital p por nivel de energa tiene que recibir un electrn antes de. a travs de orbitales moleculares que se expresan como combinaciones lineales de orbitales atmicos de la capa de valencia. Las transiciones electrnicas a orbitales moleculares ms externos dan lugar a las denominadas transiciones Rydberg presentes en el Ultravioleta de Escribe la configuracin electrnica de las siguientes especies moleculares en estado fundamental: O2, O2, O22, O2, O22. TIPOS Y FORMAS DE ORBITALES Cada orbital describe una distribucin especfica de densidad electrnica en el espacio, dada por su densidad de probabilidad. Por tanto, cada orbital tiene una energa y una forma caractersticas. Universidad de San Carlos de Guatemala Escuela de Formacin de Profesores de Enseanza Media Programa Acadmico Preparatorio Curso: Qumica NIVELES DE ENERGA, SUBNIVELES, ORBITALES Y ELECTRONES PAPQUMICA Las configuraciones orbitales de electrones proporcionan una estructura para comprender las reacciones qumicas, que se guan por el principio de la bsqueda de la configuracin de electrones con la energa ms baja (ms estable). Al referirnos a la configuracin electrnica (o peridica) estamos hablando de la descripcin de la ubicacin de los electrones en los distintos niveles (con subniveles y orbitales) de. Estos orbitales son zonas donde la probabilidad de que el electrn se encuentre es mayor. As hemos definido orbitales de cuatro tipos: s, p, d y f. Cada uno de ellos tiene una capacidad determinada para alojar electrones y una forma determinada, entendiendo esta forma como zonas de. Constelaciones de satlites Ramn Martnez RodrguezOsorio Comunicaciones por Satlite. 4) 10 satlites Altura km 2 planos orbitales (i45) Sistema ICO (MEO) Constelaciones LEO vs MEO Comunicaciones por Satlite. Los pares de electrones pueden ser de dos tipos dependiendo de s forman parte, o no, de un enlace, clasificndose en pares de enlace y pares sueltos ( tambin denominados pares libres o pares no enlazantes). Tambin existen otros tipos de orbitales, como d, h, etc. , pero los elementos conocidos, en sus estados normales no cumplen condiciones cunticas para que se den estos tipos de orbitales. Mejor respuesta: Al enlazar dos tomos, los orbitales atmicos se fusionan para dar orbitales moleculares de dos tipos: Enlazantes: De menor energa que cualquiera de los orbitales atmicos a partir de los cuales se cre. Se encuentra en situacin de atraccin, es decir, en la regin internuclear. Antienlazantes: De mayor energa, y en consecuencia, en estado de repulsin. Los tipos de orbitales moleculares son: Orbitales enlazantes: combinacin de orbitales atmicos s con p (ss pp sp ps). Enlaces sencillos con grado de deslocalizacin muy pequeo. Orbitales con geometra cilndrica alrededor del eje de enlace. Tambin para efectos de comprensin, la comunidad cientfica ha aceptado que los nmeros que representan los subniveles (0, 1, 2, y 3) sean reemplazados por las letras s, p, d y f, respectivamente, para representar los distintos tipos de orbitales. Este enlace se conoce como enlace sigma, y se obtiene del pareamiento de electrones debido al solapamiento de dos orbitales s, o de un orbital s con un orbital Px, o de dos orbitales Px, o de cualesquiera dos orbitales atmicos que se solapen a lo largo del eje internuclear (eje de X). Forma y tamaos de los orbitales. La imagen de los orbitales empleada habitualmente por los qumicos consiste en una representacin del orbital mediante superficies lmite que engloban una zona del espacio donde la probabilidad de encontrar al electrn es del 99. FORMAS Y TIPOS DE ORBITALES DEFINICIN DE UN ORBITAL ATMICO I Los orbitales atmicos es el lugar en donde tenemos una mayor probabilidad de encontrar al menos un electrn, segun la ecuacin de Erwin Schrdinger RECOMENDACIONES. Holaa alguien me ayuda con estas dos preguntas de qumica porfa es para hoy 1, Que aplicaciones tienen reacciones de neutralizacion en el campo de la salud 2. Curva de energa potencial de enlace 3. Enlace covalente y estructura molecular 3. Enlace inico y compuesto inicos 3. Enlace metlico y sus propiedades Si hay orbitales de idntica enega disponibles (ej: los 3 orbitales 2p) los electrones los ocupan de forma desapareada. Son posibles otros tipos de orbitales como g, h, pero los elementos que conocemos, en sus estado fundamental, no presentan electrones que cumplan las condiciones cunticas necesarias para que se den estos otros tipos de orbitales. Para los tomos, la notacin contiene la definicin de los orbitales atmicos (en la forma n l, por ejemplo 1s, 2p, 3d, 4f) indicando el nmero de electrones asignado a cada orbital (o al conjunto de orbitales de la misma subcapa) como un superndice. que pueden ser de cuatro tipos: s, p, d, f. Anlogamente al caso anterior, los orbitales p presentan n2 nodos radiales en la densidad electrnica, de modo que al incrementarse el valor del nmero cuntico principal la probabilidad de encontrar el electrn se aleja del ncleo atmico. Existen siete tipos de orbitales f (que corresponden a m3. 2) Los orbitales f (l3) tambin tienen un aspecto multilobular. Los orbitales d (l2) tambin estn formados por lbulos. A su vez, cada nivel tiene sus electrones repartidos en distintos subniveles, que pueden ser de cuatro tipos: s, p, d, f. En cada subnivel hay un nmero determinado de orbitales que pueden contener, como mximo, 2 electrones cada uno. Los estados orbitales de un tomo no son ms que soluciones particulares de la ecuacin de Schrdinger que determinan la evolucin de la funcin de estado y con ello la evolucin en funcin del tiempo de las regiones donde es ms fcil encontrar el electrn..